¿Sabías que la que la sangre humana y el agua de mar son ejemplos importantes de soluciones amortiguadoras?
¡Tal vez te animes, y leas la información que te presento en el siguiente artículo!
¡Veamos cómo funcionan y su importancia!

¿Cómo funcionan las soluciones amortiguadoras?
Si se tiene por ejemplo, una solución buffer de HC2H3O2/C2H3O2-. Su ionización viene determinada por la siguiente reacción en equilibrio
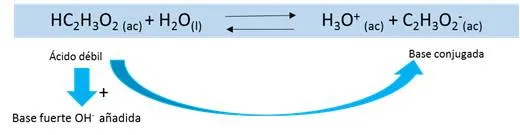
Cuando se añade una pequeña cantidad de base fuerte, los iones OH- entrantes extraen protones de la molécula de CH3COOH para producir iones C2H3O2- y moléculas de H2O, es así como las moléculas de ácido acético actúan como una fuente de protones. Debido a que se reemplazó una base fuerte por una base débil la concentración de iones OH- permanece casi inalterada. Es así como el pH permanece casi inalterado también.
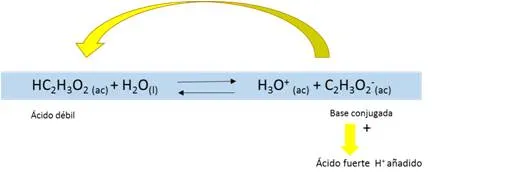
Por otro lado, cuando se añade un ácido fuerte a una solución que contiene iones C2H3O2- y moléculas de CH3COOH, iones H3O+ recién llegados transfieren protones a los iones C2H3O2- para formar CH3COOH y moléculas de H2O. Ya que los iones hidronio son removidos por los iones acetato, el pH permanece casi inalterado.
¿Cuánto pueden resistir?
De igual forma que una esponja puede retener solo una determinada cantidad de agua, las soluciones amortiguadoras, pueden responder solo de una determinada cantidad de protones. Sus fuentes y sumideros se agotan si se añade demasiado ácido o base fuerte a la solución. Su capacidad amortiguadora, viene dada por la máxima cantidad de ácido o base que puede añadirse antes de que la solución amortiguadora pierda su capacidad para resistir grandes cambios de pH.
La solución amortiguadora se agota cuando la mayor parte de su base débil se ha convertido en su ácido conjugado o cuando la mayor parte del ácido débil se ha convertido en su base conjugada. La capacidad amortiguadora también depende de las concentraciones relativas de ácido y base débiles. Experimentalmente se sabe que tiene alta capacidad cuando la cantidad de base presente es de al menos 10% de la cantidad de ácido, y la cantidad del ácido es de al menos 10% de la cantidad de la base. De otra manera, la base es utilizada por completo rápidamente al añadir ácido o el ácido será consumido por completo a medida que se adiciona la base. Utilizando estos porcentajes para expresar el rango de acción de la solución amortiguadora en términos de pH de la solución se tiene que, la solución amortiguadora actúa efectivamente dentro de un rango de ±1 unidades de pKa[2].
¡Algunos ejemplos de soluciones amortiguadoras!
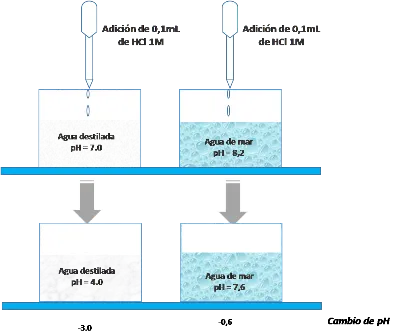
Tomemos en primer lugar como ejemplo, el comportamiento del agua de mar. El pH del agua de mar es de aproximadamente 8,2.
Si en un laboratorio realizamos una simple prueba, y a 1 L de agua de mar se le adiciona 0,1 mL de una disolución ácida 1 M de HCl, y se compara con el pH de 1 L de agua destilada bajo las mismas condiciones, vamos a observar que el pH del agua pura cambia en 3,0 unidades, mientras que el pH del agua de mar solamente cambia en 0,6 unidades.
¿Pero, a qué se debe esto?
Numerosas investigaciones han demostrado que el pH es básico, debido a la acción en conjunto del CO2 atmosférico y de los seres vivos que se encuentran en el interior del mar desempeñando un papel importante.
Por un lado ocurre la transformación del dióxido de carbono. Cuando se introduce en el mar se transforma en ácido carbónico, bicarbonato, carbonato y protones. Estos compuestos en el mar se encuentran en cantidades diferentes, ya que las diferentes etapas de reacción tienen lugar en diferente extensión.
Por otra parte, varias especies de seres vivos acuáticos evolucionaron con una forma de protección a partir de un caparazón calcáreo. La fabricación de este caparazón se basa en segregar iones calcio, que junto al carbonato presente en el agua, genera el carbonato de calcio que es un sólido bastante insoluble, cuya función es la de recubrir gradualmente las partes blandas del organismo.
El consumo de carbonato, para formar carbonato de calcio, trae como consecuencia el desplazamiento del pH hacia valores más básicos, así como una presencia mucho mayor de bicarbonato disuelto en el agua, lo que permite mantener el pH en el rango[3].
Entonces, el control de pH se debe a que las propias sustancias que se encuentran disueltas en el agua de mar limitan el cambio en la H+ después de la adición de HCl.
¿Qué importancia tiene?

Algunos estudios han demostrado que los animales se están viendo afectados negativamente por las altas concentraciones de dióxido de carbono. Sin embargo, no todas las especies sufren por igual la acidificación. Mientras los peces se están adaptando relativamente bien a esta reducción del pH del agua, otras especies con metabolismo más lento, se llevan la peor parte. Por ejemplo, en el caso de los corales, esto provoca una débil calcificación que, aunado a la elevación de la temperatura del agua, está acabando con ellos en varios lugares del planeta [4].
¡La sangre, otro ejemplo importante!
El pH de la sangre humana oscila entre 7.39 y 7.45, por lo que es ligeramente básica. Su valor en una persona sana comúnmente no difiere en más de 0,2 unidades del valor promedio. Cuando su valor decae por debajo de 7.4, la condición se conoce como acidosis y cuando se encuentra por encima de este valor se conoce como alcalosis [1].
¿Qué sucede cuando hay un cambio de pH en el cuerpo humano?
Cualquier variación significativa en el valor de pH, es decir si cae por debajo de 6,8 o se eleva por encima de 7,8 dará como resultado una severa respuesta patológica y en ocasiones puede ocurrir la muerte.
¿Qué relación hay entre el pH de la sangre y las soluciones amortiguadoras?
La sangre humana es un medio acuoso muy complejo, con un pH amortiguado más o menos a 7.4. El cuerpo por sí solo emplea dos mecanismos fundamentales para el control del pH en la sangre, ellos son la respiración y la excreción. La sangre contiene numerosos amortiguadores, incluyendo el par H2CO3/ HCO3- y H2PO4-/HPO4-2 y pares conjugados ácido-base contenidos en la hemoglobina. La concentración del ácido carbónico (H2CO3), está controlada por la respiración. A medida que exhalamos vaciamos nuestro sistema de CO2 y por ende también de H2CO3. La concentración de HCO3- está controlada por su velocidad en excreción de la orina.
El equilibrio involucrado es
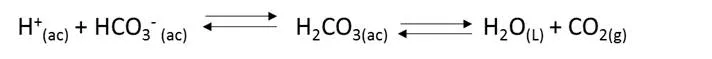
¡Algunos casos que producen variación de pH en la sangre!
La acidosis respiratoria, es producida por una disminución en la respiración lo que conduce a la elevación del CO2 en la sangre. El asma, neumonía, inhalar humo la pueden producir en el organismo. Se puede tratar con ventilación mecánica para ayudar a la respiración. Al mejorar la exhalación, aumenta la excreción de CO2 y se eleva el pH sanguíneo.
La acidosis metabólica, se produce cuando se liberan en el torrente sanguíneo cantidades excesivas de ácido láctico. Ejemplo de ello es el ejercicio pesado, la diabetes, el ayuno y quemaduras graves. Estos casos resultan de gran importancia, ya que al producirse, el plasma sanguíneo escapa del sistema circulatorio hacia el área dañada produciendo hinchazón y reduciendo así el volumen sanguíneo. Si el área quemada es muy grande, la pérdida de volumen sanguíneo puede ser suficiente para ocasionar una reducción en el flujo sanguíneo y el suministro de oxígeno a los tejidos corporales. Esta falta de oxígeno hace que los tejidos produzcan gran cantidad de ácido láctico. Cuando se produce esta disminución de pH, la persona tiende a respirar más intensamente para eliminar CO2. Sin embargo, si la disminución del volumen sanguíneo supera la capacidad compensadora del organismo, el descenso del flujo sanguíneo disminuye aún más, disminuye la eliminación de CO2 y se agrava la situación. Esta situación se puede tratar con infusión intravenosa de grandes volúmenes solución salina, ya que el líquido suministrado incrementa el volumen de sangre y fluye, mejorando la distribución de oxígeno. La relación H2CO3/ HCO3- se normaliza y permite que la persona mejore.
En el plasma sanguíneo, la composición de iones HCO3- es alrededor de 20 veces la de H2CO3, esta diferencia pareciera estar fuera del rango de regulación óptima. Sin embargo, los principales desechos de las células vivas son los ácidos carboxílicos, como el ácido láctico. El plasma con su concentración relativamente alta de iones HCO3- , puede absorber un incremento súbito de iones hidrógeno provenientes de estos ácidos carboxílicos, ayudando a compensar los trastornos que ocasionan estos excesos [2].
La alcalosis respiratoria, se produce por un aumento de pH asociado con una respiración excesiva. Una causa común puede ser la hiperventilación provocada por ansiedad o fiebre elevada. El cuerpo puede controlar esta variación con un desmayo, que reduce la frecuencia respiratoria.
La alcalosis metabólica, se produce por un incremento de pH causado por una enfermedad o ingestión química. El vómito repetido o el empleo excesivo de diuréticos la pueden ocasionar. El cuerpo, lo compensa por medio de la disminución en la frecuencia respiratoria [2].
¡Es así como el conocimiento de los sistemas amortiguadores y su funcionamiento resulta de gran importancia, ya que son vitales para la existencia de los organismos vivos!
¡Hasta un próximo post, espero les sea de gran ayuda la información presentada!
Referencias Bibliográficas
[1] Brown, T. y Lemay, H. QUÍMICA. LA CIENCIA CENTRAL. Editorial Prentice Hall. 3ra. Edición.
[2] Atkins, J y Jones, L. (2006). PRINCIPIOS DE QUÍMICA. Los caminos del descubrimiento. Editoral Médica Panamericana.
[3] Investigación y Ciencia (2015). El mar es básico. Disponble en: https://www.investigacionyciencia.es/blogs/fisica-y-quimica/39/posts/el-mar-es-bsico-13433
[4] Green Area (2017). El pH del mar contra la vida. Disponble en: http://greenarea.me/?p=199187.
