Fundamentos teóricos
Una de sus aplicaciones es la determinación del contenido total de nitrógeno, empleando el “Método de Kjeldahl”. Este método se emplea en la determinación de nitrógeno en una gran cantidad de muestras que pueden ser orgánicas e inorgánicas, tales como carnes, cereales, bebidas, harina de trigo, entre otras, para conocer su contenido de proteínas, y también se emplea en muestras de aguas residuales y suelos.
El método en forma general, consiste en descomponer la muestra con ácido sulfúrico concentrado con la finalidad de convertir el nitrógeno combinado en ion amonio. La solución posteriormente se vuelve básica, así el amoniaco que se libera se destila y se determina por medio de una titulación de neutralización.

Figura 1. Etapas del método de Kjeldahl para la determinación de nitrógeno.
Fuente: propia
Etapas del método

La digestión es una de las etapas más complicadas del método, su finalidad es convertir todo el nitrógeno orgánico en iones amonio. Cabe destacar, que la transformación del nitrógeno depende de su estado de combinación en la muestra original. Cuando se encuentra en grupos amino, y amida se transforma en ion amonio, cuando está presente en grupos nitro, azo puede formar nitrógeno elemental o algunos óxidos de nitrógeno que se pierde en medio ácido caliente. En la determinación del nitrógeno kjeldahl total se incluye el nitrógeno orgánico y el amoniacal. El nitrógeno amoniacal se encuentra en solución acuosa en forma de ion amonio o amoniaco dependiendo del pH del medio por el siguiente equilibrio:

A pH mayores de 7 el equilibrio se desplaza hacia la izquierda, y a pH menores que 7 hacia la derecha.
En la digestión se adiciona ácido sulfúrico concentrado, trabajando a pH bajos para así convertir el nitrógeno amino en ion amonio. La descomposición puede consumir bastante tiempo, por lo que en algunas modificaciones del método se puede emplear solución de peróxido de hidrógeno como un oxidante adicional.


En esta etapa del método los iones amonio se convierten en amoníaco por medio de la adición de una base como NaOH. El NH3 formado es arrastrado por medio de una corriente de vapor.

El amoníaco destilado se puede recoger en un volumen no medido de ácido bórico, ácido clorhídrico o sulfúrico. Sin embargo, el uso de cada uno determinará el procedimiento a seguir en la siguiente etapa así como también los reactivos a emplear.
En este caso estudiaremos la destilación recogiendo el nitrógeno sobre ácido bórico para así retenerlo y posteriormente llevar a cabo la titulación.


Cuando se emplea el ácido bórico como absorbente, la muestra luego de la destilación se titula directamente con una solución de ácido sulfúrico o clorhídrico, hasta cambio de color.

Aplicación del método en muestra de agua gris
Metodología experimental

Preparación de la solución digestora: preparación de 3mL de solución digestora mezclando 2,25mL de ácido sulfúrico concentrado con 0,75mL de peróxido de hidrógeno.
En esta etapa se procedió a medir 50 mL de muestra y se trasvasó a un balón de cuello largo, se adicionó la solución digestora previamente preparada y se calentó cuidadosamente a ebullición hasta reducir el contenido a 10mL aproximadamente.
Nota: Todo esto realizado bajo campana.

Figura 2: Digestión de una muestra de agua gris
Fuente: propia
Al finalizar la digestión, se enfría la muestra y se diluye hasta 50 mL con agua destilada, esto con la finalidad de evitar salpicaduras cuando posteriormente se le adicione la base al ácido concentrado.

En esta etapa se procedió a trasvasar los 50 mL de la muestra al balón de destilación y se adicionaron cuidadosamente 40 mL de NaOH 6N. Se montó el equipo para la destilación con vapor y se recogió entre 75-100 mL de destilado, adicionando previamente en el matraz recolector del destilado solución del indicador mixto (rojo de metilo y azul de metileno) conocido como indicador de Tashiro, y se adicionó el ácido bórico.

Figura 3: Unidad de destilación del amoníaco
Fuente: propia
Cuando el amoníaco reacciona con el ácido bórico, se observa el cambio de color de azul intenso a verde, indicando la presencia de nitrógeno en la muestra analizada.

Figura 4: Recolección del amoníaco en la destilación de la muestra
Fuente: propia

Una vez culminada la destilación, se deja enfriar el destilado y se titula con ácido sulfúrico 0.02N hasta cambio de color inicial (azul intenso, esto debido a que predomina el color del azul de metileno), se registra el volumen de solución titulante gastado y su concentración. Posteriormente se debe realizar una valoración en blanco.

Figura 5. Valoración ácido-base
Fuente: propia
Determinación cuantitativa del contenido de nitrógeno total
Tomando como dato el volumen gastado en la valoración de la muestra y en el blanco se puede aplicar la siguiente ecuación cuando se utiliza el ácido bórico como absorbente:

Resultados
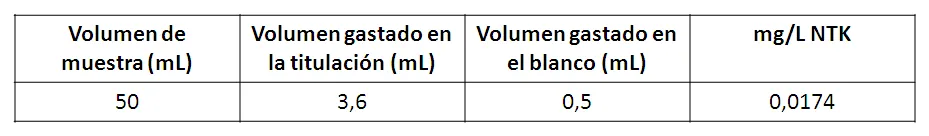
Como se puede observar, la muestra de agua gris analizada por el método Kjeldahl contiene 0,0174 mg/L de N. Según las normas para la clasificación y el control de la calidad de los cuerpos de agua y vertidos o efluentes líquidos, éste parámetros no tiene un límite máximo permisible específicamente para el agua tipo 2, que corresponden a aquellas aguas que se pueden destinar para riego.
Sin embargo, en la sección III, capítulo III de dicha norma, se establece como límite máximo de calidad de vertidos líquidos que se descarguen de manera directa o indirecta en ríos, lagos, embalses 40 mg/L de contenido de nitrógeno total, por lo que en dichos casos resulta importante su control.

Importancia de la cuantificación de nitrógeno en aguas residuales
En el agua, los compuestos nitrogenados, son de gran importancia ya que su presencia ayuda al crecimiento de los organismos vivos en el medio acuático. Naturalmente provienen de la degradación de la materia orgánica muerta. Sin embargo, la actividad del hombre aporta cantidades adicionales proveniente de los vertidos urbanos, de las industrias, y de la agricultura.
En aguas residuales, el nitrógeno se encuentra presente principalmente en forma de nitrógeno orgánico y nitrógeno amoniacal. Si estas aguas son descargadas con una alta concentración de nutrientes como el fósforo y nitrógeno, esto ocasiona un crecimiento acelerado de las especies, que al morir se descomponen, cubren gran parte de la superficie, y por ende hay mayor consumo de oxígeno disuelto, originando malos olores y disminuyendo así la calidad del agua, por lo que se va deteriorando el ecosistema.
Es así, como la determinación del contenido de nitrógeno es un indicativo de la calidad del agua, por medio de la cuantificación de su concentración es posible establecer la necesidad de sistemas de tratamientos para su depuración y así lograr su reducción o eliminación.
Referencias Bibliográficas
Skoog W., Holler C.(2001). Química analítica. 7ma edición.
Normas para la clasificación y el control de la calidad de los cuerpos de agua y vertidos o efluentes líquidos. Decreto 883. Gaceta oficial 5021. Diciembre 1995
