
Figura 1. Ejemplo de productos que contienen ácidos y bases en el hogar. Fuente: elaboración propia
En la cocina, muchas frutas y alimentos de uso común contienen ácidos en su composición. Por ejemplo las naranjas, limones, y en general las conocidas como frutas cítricas contienen el ácido cítrico, de ahí su nombre. Otras frutas como es el caso de las manzanas contienen ácido málico, el yogurt contiene ácido láctico. El ácido tartárico forma parte de las uvas, y es el componente que le otorga esa característica acidez. Otro alimento ácido por excelencia es el vinagre, el cual en su composición cuenta con el ácido acético. Muchos ácidos se emplean como conservantes de alimentos para evitar la acción bacteriana ya que se mantiene pH bajos. Algunos ejemplos son el ácido cítrico, benzoico, entre otros. Es por ello, que por ejemplo, al preparar un escabeche se utiliza el vinagre y jugo de limón. También pueden ser utilizados como aderezos en las comidas. En repostería se utilizan mezclas de bicarbonato y ácido tartárico ya que su reacción produce CO2 (g), lo cual facilita obtener mezclas más esponjosas.

Figura 2. Uso del vinagre (ácido acético) como conservante. Fuente: elaboración propia.
También es conocido el ácido clorhídrico el cual, junto a otras sustancias, lo podemos encontrar formando parte del jugo gástrico de nuestro estómago, en donde realiza la función esencial de la digestión de los alimentos que ingerimos, y además también actúa activando enzimas digestivas. Cuando se presentan problemas de digestión debido al exceso de ácido clorhídrico en el estómago, se pueden emplear bases débiles para neutralizar su efecto tales como hidróxido de magnesio o leche de magnesia.
Para la limpieza en el hogar, se usa comúnmente sustancias que contienen amoníaco, el cuál es una base débil. También se emplea la sosa cáustica o el hidróxido de sodio, siendo éste una base fuerte que se utilizan con frecuencia para la limpieza de cañerías. Todos estos productos por lo general se encuentran muy concentrados, por lo que deben ser utilizados con mucha precaución.
La acidez o basicidad de los productos de higiene corporal, como el champú o gel de baño, también pueden influenciar en la óptima salud de la piel o el cabello. El cabello se encuentra constituido por largas cadenas proteicas unidas por enlaces de diferentes tipos. Los enlaces más débiles son los de hidrógeno, pues simplemente se pueden romper al mojar el pelo, aunque por lo general se vuelven a formar cuando este se seca. Si un champú posee un pH menor que 4 o mayor de 8, afectaría en mayor o menor grado las uniones que existen en la cadena de proteínas, en especial si el champú es fuertemente alcalino, lo que volvería al cabello quebradizo, eliminando la grasa protectora y deshidrataría el cuero cabelludo. En general, las sustancias y productos para la higiene personal que sean muy alcalinos resecarán la piel.
En la naturaleza podemos encontrar el ácido carbónico, que es fundamental para mantener constante el pH en la sangre, jugando un papel importante en los seres vivos. La mayoría de los ácidos y las bases que existen en la naturaleza son débiles.
Determinación cuantitativa
La concentración de un ácido o una base se puede determinar por medio de una titulación.

Figura 3. Titulación. Fuente: elaboración propia
Titulaciones basadas en las reacciones ácido-base
Titulación de base fuerte con ácido fuerte / ácido fuerte con base fuerte
En la titulación en donde se agrega ácido fuerte a una base fuerte, al inicio el pH cae lentamente. Luego, en el punto de equivalencia se produce un descenso abrupto del pH pasando por el valor de 7. En este punto, el indicador cambia de color o un titulador automático responde al cambio súbito de pH. Las titulaciones suelen finalizar en este punto.
La curva en la cual el analito es un ácido fuerte y el titulante la base fuerte, es la imagen especular de la anterior. Se parte de un pH ácido a un pH básico.

Figura 4. Valoración ácido fuerte- base fuerte. Fuente: elaboración propia
Titulación de ácido débil con base fuerte / base débil con ácido fuerte
En este tipo de curva, la característica principal es que el punto de equivalencia no tiene lugar a pH 7. Aunque el pH cambia de forma razonablemente repentina cerca del ese punto, no cambia tan abruptamente como ocurre en la valoración de especies fuertes. El pH en el punto de equivalencia depende del tipo de sal producida en la reacción de neutralización. Y más allá del punto de equivalencia depende del exceso de titulante añadido.
En la valoración de un ácido débil (HA), las especies predominantes en cada zona son:

Figura 5. Titulación ácido débil con base fuerte. Fuente: elaboración propia
En el caso de una valoración de base débil, en el punto de equivalencia tiene lugar a un pH menor a 7, ya que la sal formada contiene un catión que se hidroliza.

Figura 6. Titulación base débil con ácido fuerte. Fuente: elaboración propia
¿Cómo detectar el punto final en una titulación?
Determinación del punto final con un indicador visual
Un grupo interesante de ácidos y bases débiles derivados de colorantes orgánicos pueden servir para determinar el punto final en este tipo de valoraciones. Como estas sustancias tienen al menos una especie ácido-base conjugada de color muy marcado, en la valoración se producen cambios tanto de pH como de color. El pH al que cambia de color el indicador depende de su constante de disociación. Cuando el indicador, por ejemplo, es un ácido débil monoprótico HIn, su reacción de disocian es:
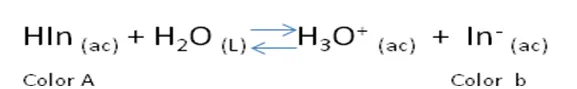
Las dos formas del indicador, HIn y In- son de distinto color. Por tanto, El color de una disolución que contenga el indicador cambiará continuamente a medida que la concentración de HIn y In- varíen también.
Un ejemplo típico es la fenolftaleína, cuyo límite de pH se encuentra entre 8.3 y 10.0. Su color en medio básico es rosa y en medio ácido es incoloro.

Figura 7. Indicador en una titulación ácido-base. Fuente: elaboración propia
Determinación del punto final mediante el monitoreo de pH
Otra forma de detectar el punto final en una valoración es controlando la reacción con un sensor adecuado, cuya señal cambie en función de la concentración del analito. El sensor utilizado en este tipo de valoración es un electrodo de pH.

Figura 8. Medición de pH con un pHmetro. Fuente: elaboración propia
La representación grafica de los datos nos proporciona la curva de valoración respectiva. El método para determinar el volumen en el punto final consiste en localizar visualmente el punto de inflexión de la curva de valoración por simple inspección y trazar una línea vertical que corte el eje del volumen.
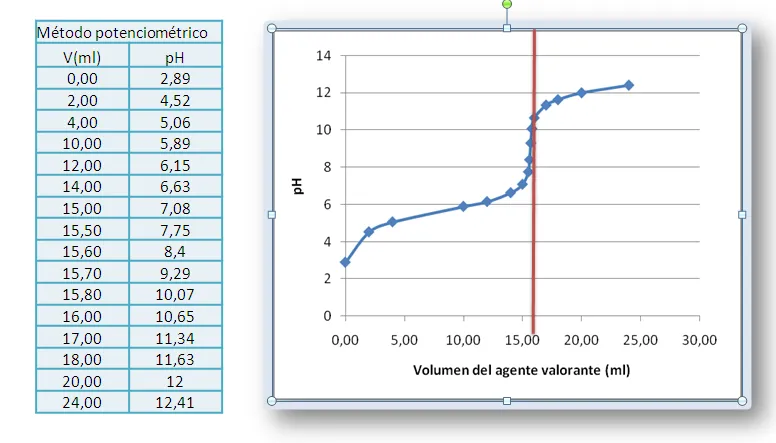
Figura 9. Curva de valoración de un ácido débil con NaOH 0.1M. Datos tomados de Harvey D. (2002). Fuente: elaboración propia
Determinación del punto final por el método de la primera y segunda derivada
Otro método para determinar el punto final consiste en representar la primera o segunda derivada de la curva de valoración. En la primera derivada, la pendiente de la curva de valoración alcanza su valor máximo en el punto de inflexión. Por tanto, la primera derivada muestra un máximo distinto para cada punto final. Se calcula de forma aproximada por el ∆pH /∆V, donde ∆pH es el cambio de pH entre adiciones sucesivas de agente valorante y se grafica en función al volumen promedio.

Figura 10. Gráfica de la primera derivada de la valoración de un ácido débil con NaOH 0.1M. Fuente: elaboración propia
Gráficamente se puede determinar el volumen en el punto final trazando una línea vertical que pase por el máximo de la curva y corte el eje del volumen.
La segunda derivada de una curva de valoración puede ser más útil que la primera ya que el punto final viene indicado por su corte con el eje del volumen. Se calcula de forma aproximada a partir de ∆ (∆ pH /∆V)/ ∆V, y se grafica en función al volumen promedio.

Figura 11. Gráfica de la segunda derivada de la valoración de un ácido débil con NaOH 0.1M. Fuente: elaboración propia
¡Espero sea de gran utilidad la información presentada, hasta un próximo post amigos de stemeet!
Referencias bibliográficas
Ácidos y bases en la vida cotidiana. Disponible en: https://quimica.laguia2000.com/acidos-y-bases/acidos-y-bases-en-la-vida-cotidiana
Skoog W., Holler C. Química analítica. 7ma edición
Harvey, D. (2002). Química Analítica Moderna.
