Saludos estimados amigos de steemit y apreciada comunidad de @stem-espanol.
El ácido sulfúrico es un producto químico muy importante, este ácido es muy conocido en cualquier laboratorio químico y sus características le han conferido una amplitud de usos industriales que lo han convertido en uno de los ácidos con mayor demanda. En soluciones de diferentes concentraciones el ácido sulfúrico se emplea en la preparación de fertilizantes fosfatados, la elaboración de pigmentos, fármacos, explosivos, detergentes, la refinación del petróleo y en diversos procesos metalúrgicos, como el decapado del acero[1], y una de las aplicaciones con la quizás estamos más familiarizados es su uso como electrolito en las baterías de vehículos. Por sus diversos usos quiero compartir algunos hechos y características importantes de este compuesto químico.

Ácido sulfúrico grado reactivo en presentación de 2,5 L. Fuente: @emiliomoron.
El ácido sulfúrico puro es un líquido incoloro, de aspecto aceitoso y muy corrosivo, es uno de los ácidos más fuertes de los que se dispone, por ello es muy importante cumplir con las medidas de seguridad correspondientes para su manipulación. Comercialmente el ácido sulfúrico concentrado (el grado reactivo disponible para laboratorios) se puede conseguir hasta con 98 % de pureza, este tiene una gravedad específica de 1,84 a 20 ºC, congela a -15 ºC aproximadamente y hierve a una temperatura superior a los 310 ºC, descomponiendose a una temperatura de 338 ºC[2].
Un poco de historia
El descubrimiento del ácido sulfúrico se remonta al siglo VIII, cuando la química aun era alquimia, siendo atribuido su descubrimiento al alquimista medieval Jabir ibn Hayyan (Geber), aunque fue un siglo más tarde que el médico y alquimista Ibn Zakariya al-Razi (Rhases) pudo sintetizar la sustancia a partir de la destilación de algunos minerales, como el sulfato de hierro (FeSO4.7H2O) y el sulfato de cobre (CuSO4.5H2O)[1]; es comprensible que tomaran esta ruta en aquella época, al calentar estas sustancias se descomponen en trióxido de azufre y agua, y al mezclarse el trióxido de azufre con agua reaccionan para producir una solución muy poco concentrada de ácido sulfúrico, una reacción que podemos escribir como:
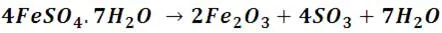
El ácido sulfúrico se popularizo entre los alquimistas europeos con el nombre de aceite de vitriolo, licor de vitriolo, o algunos otros nombre relacionados con vitriolo. El nombre vitriolo se deriva del latín vítreo, que significa vidrio, al parecer este nombre se le dio al ácido ya que las sales de sulfato del cual fue obtenido eran nombradas así por su aspecto vítreo, por ejemplo el sulfato cúprico, era conocido con el nombre de vitriolo azul. Por lo que era lógico nombrar al líquido destilado de esta sal como aceite de vitriolo. En la siguiente imagen podrán observar el aspecto de los cristales de la sal de sulfato cúprico y su semejanza con cristales de vidrio.

Cristales de sulfato cúprico penta hidratado. Fuente: @emiliomoron.
Para el siglo XVII se sentaron las bases para la producción industrial del ácido sulfúrico, partiendo del método implementado por el químico alemán Johann Glauber, el cual preparó el ácido quemando azufre con nitrato de potasio (KNO3) en presencia de vapor de agua. En esta reacción, a medida que el KNO3 se descompone oxida el azufre a SO3, que luego se combina con el agua para producir el ácido.
En 1746 John Roebuck utilizó este método para producir ácido sulfúrico a mayor escala, para ello sustituyó los recipientes de vidrio que eran empleados por cámaras con revestimiento de plomo, que eran más grandes y resistentes. Con esta y otras condiciones implementadas por Roebuck se pudo mejorar el refinamiento del ácido y elevar la concentración entre 35 y 40 % de pureza. Posteriores mejoras implementadas por el químico Joseph-Louis Gay-Lussac permitieron elevar la concentración a 78%[3].
Ese sería el método utilizado para la fabricación de ácido sulfúrico por más de un siglo, sin embargo, la necesidad de nuevos pigmentos para producir tintes presionaban por un ácido de concentración más elevada, que podía obtenerse por destilación de sales de sulfatos, pero los bajos rendimientos lo hacían muy costoso. Sería hasta 1831 que Peregrine Phillips registró la patento de un método para producir ácido sulfúrico concentrado, el cual se convirtió esencialmente en la forma de obtener ácido sulfúrico hasta la fecha, este método hoy día se conoce como el método de contacto.
Fórmula y estructura
La fórmula molecular del ácido sulfúrico se escribe como H2SO4, lo que corresponde a un ácido diprotico; que puede ceder dos iones hidronio (H+), los cuales están unidos a un grupo sulfato (SO42-). La representación esquelética de la molécula se describe en la siguiente imagen.

Representación esquelética (propia) y modelo molecular (tomado de wikipedia, CC BY-SA 4.0) del ácido sulfúrico.
En la molécula, el átomo de azufre esta enlazado a dos átomos de oxígeno mediante enlaces dobles, y a esta unido a dos grupos hidroxilo mediante enlaces simples.
Algunas características
- El ácido sulfúrico es uno de los ácidos minerales más fuertes, perteneciente al grupo de los oxidantes fuertes. Tiene una fortaleza ácida de -12, expresa como acidez de Hammett, por lo que abre la lista de los compuestos superácidos.
- Es soluble en agua en cualquier concentración, pero en soluciones concentradas reacciona de forma violenta con el agua, el calor de la hidrólisis es tan extremo que puede causar graves quemaduras.
- Por otro lado,cuando se calienta se descompone en SO3, por lo que emite humos bastante tóxicos.
- Es un ácido altamente reactivo, incluso llega a encender materiales combustibles al contacto con ellos, por lo que también resulta incompatible su almacenamiento junto con un gran número de sustancias.
Usos más comunes
Directos
Quizás la aplicación más conocida donde se emplea el ácido sulfúrico de forma directa es en las baterías de plomo ácido de los vehículos, sin embargo en términos de volumen no es la aplicación con mayor consumo de ácido; esta podría ser la sulfatación de compuestos organicos, donde se emplea el ácido sulfúrico para incorporar el átomo de azufre en un producto final, obteniendose un ácido sulfonico. Estos ácidos sulfonicos son intermedios valiosos para la producción de detergentes, colorantes y productos farmaceuticos[4]. En la siguiente imagen se muestra la reacción de sulfatación del benceno para producir el ácido benceno sulfónico, el cual se utiliza como materia prima para los detergentes en polvo.

Otros compuestos sulfurados importantes en la industria de los detergentes son los alcoholes grasos sulfatados. Los cuales se obtienen al hacer reaccionar los alcoholes grasos derivados del coco o el palmiste con un reactivo sulfatante fuerte como el trioxido de azufre o el ácido sulfúrico al 100%[5].
Indirectos
El ácido sulfúrico es quizás el ácido de mayor consumo a nivel industrial, pero encuentra mayor cantidad de usos como un reactivo para la síntesis de otros compuestos que incorporado como parte del producto final, terminando la mayor parte como un ácido gastado o algún tipo de residuo de sulfatos.
Por ejemplo, el mayor consumidor de ácido sulfúrico es la industria de los fertilizantes, representando cerca del 60% del consumo a nivel mundial. En esta industria el ácido sulfúrico se emplea para la obtención de ácido fosfórico, el cual luego es empleado para la elaboración de fertilizantes fosfatados.
La industria del petróleo también consume un volumen importante de ácido sulfúrico, en la petroquímica se emplea para proveer el medio ácido para las reacciones de deshidratación y nitración, así como en la refinación de crudo se emplea en el proceso de alquilación con ácido sulfúrico como catalizador.
La industria metalúrgica emplea cantidades importante de este ácido, especialmente en el proceso de decapado del acero, mediante el cual se utiliza para eliminar la capa de óxido adherida a la superficie de los metales y cualquier otra impureza, también se emplea para la obtención de cobre, vanadio y hasta uranio, utilizándolo como solvente para la lixiviación de los minerales que los contienen. También actúa como el electrolito de los baños químicos donde se realizan cromados y chapados de metales no ferrosos.
Como ven, en las citadas aplicaciones es empleado más durante el proceso de producción que formando parte del producto final.
Obtención de ácido sulfúrico. Método de contacto
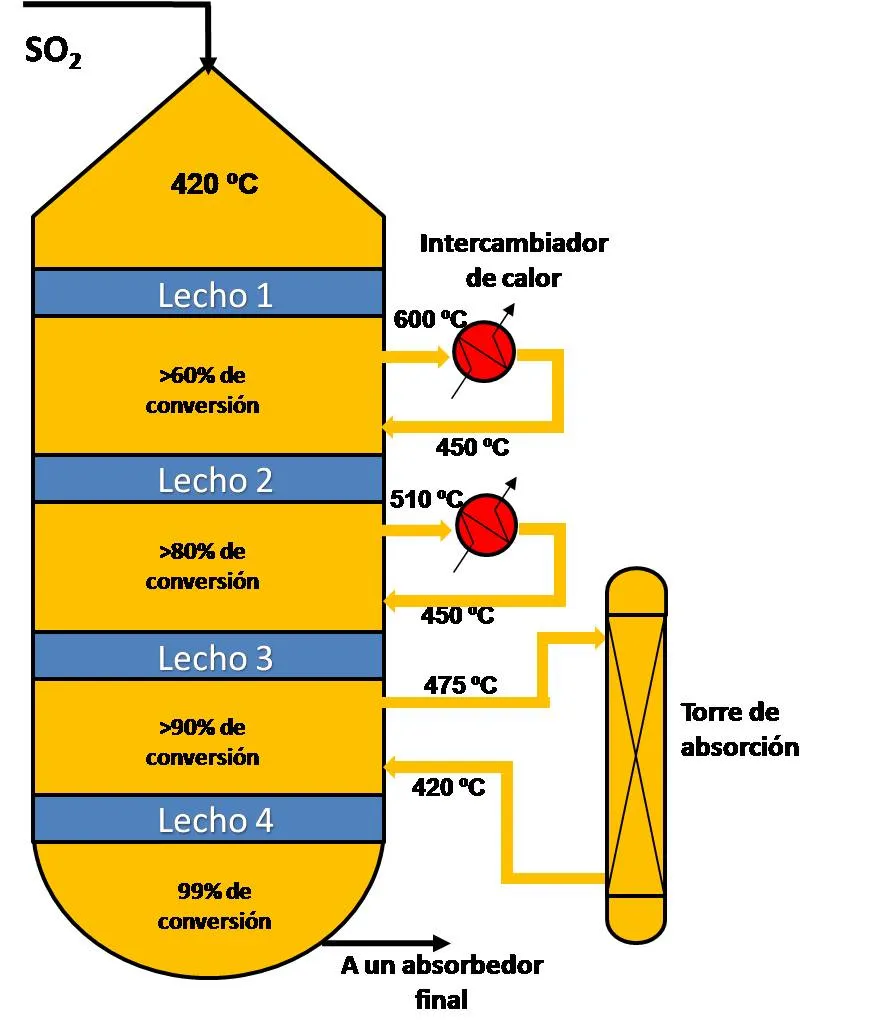
Obtención del ácido sulfúrico. Proceso de contacto Hoy día la mayor parte del ácido sulfúrico producido se obtiene por el método de contacto. Mediante este proceso, primeramente los minerales que contienen azufre se calientan en una atmósfera de oxígeno para producir dióxido de azufre (SO2), luego este dióxido de azufre se oxida a trióxido (SO3); esta es una reacción exotérmica y reversible, por lo que se debe controlar la temperatura y usar un catalizador de oxido de vanadio (V2O5) disperso en un lecho inerte para aumentar la velocidad de la reacción y evitar reconversión del producto. Los gases de reacción, aire y dióxido de azufre se alimentan en una relación 5:1 a un convertidor catalítico que posee cuatro etapas que operan a diferentes temperaturas. En las primeras tres etapas aproximadamente el 93% del dióxido de azufre se convierte a trióxido; entonces este se enfría y se pone en contacto con agua en torres de absorción, esta es una columna empacada con lechos de cerámica, donde se produce el ácido sulfúrico en el tope de la columna, este luego se alimenta a la última etapa del convertidor catalítico para lograr una conversión final del 99%, luego se alimenta a una unidad de absorción final para retirar restos de SO3 no convertido[6].
La conversión del azufre elemental en ácido sulfúrico se puede representar mediante las siguientes reacciones:
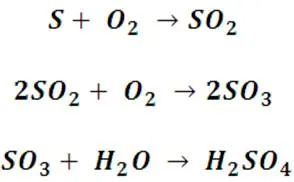
Su producción se puede esquematizar con la siguiente imagen.
Propiedades físicas
El ácido sulfúrico concentrado (98%) es un líquido con aspecto aceitoso y denso, tiene una densidad de aproximadamente 1,83 g/mL a 25 ºC, que congela a una temperatura de 10 ºC y hierve a 338 ºC. También puede observarse que humea, debido a su descomposición en trióxido de azufre y agua.
En cuanto a su solubilidad, este ácido es soluble en agua en cualquier proporción.
Propiedades químicas
Por ser un ácido fuerte se ioniza completamente en soluciones acuosas, pero tiene la particularidad de presentar una primera disociación completa y una segunda disociación parcial. Por lo tanto, el pH de una solución de ácido sulfúrico viene dado aproximadamente por los iones hidronio generados en la primera disociación. Veamos las dos disociaciones:

En cada disociación el ácido sulfúrico cede un ion hidronio, y como vemos, la primera reacción se desplaza completamente hacia los productos, pero la segunda no se completa, por lo que debemos evaluar el equilibrio en función de la constante de disociación. Para la primera reacción no se muestra una constante, ya que es tan grande que se considera infinita.
Entonces, si deseamos determinar el pH de una disolución acuosa de ácido sulfúrico, digamos que preparada para una concentración 0,1 M, debemos establecer la cantidad de iones hidronio generados. Para ello procedemos de la siguiente manera.
Para la primera disociación:
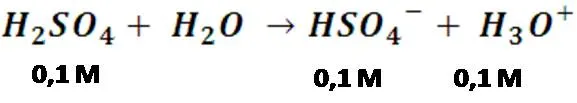
Y para la segunda:
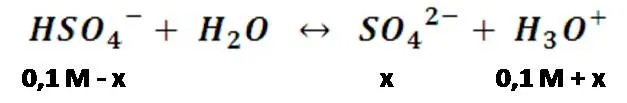
Evaluando este equilibrio en la ecuación de la constante de disociación nos queda:

Al resolver la expresión nos queda que aproximadamente x = 0,013 M, por lo tanto, la cantidad de iones hidronio generados son:
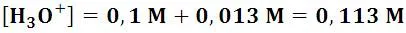
Así, esta solución tendrá un pH de:

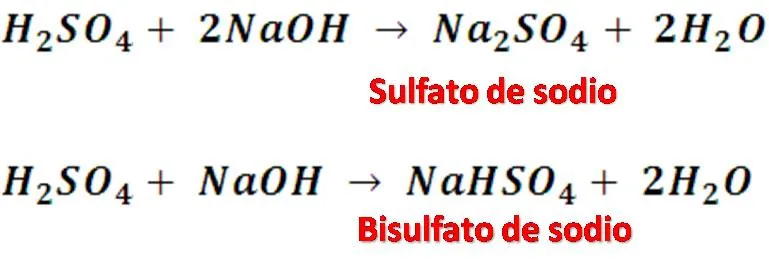
Como cualquier otro ácido, este tiene la capacidad de neutralizar bases, sin embargo; puede dar origen a uno de dos tipos de sales dependiendo de la concentración del reactivo, produciendo sulfatos y bisulfatos, por ejemplo:
Además de ser un agente oxidante fuerte, que reacciona con muchos metales, carbono, azufre y otras sustancias, actúa también como un fuerte agente deshidratante, por lo que se combina violentamente con agua. La reacción entre el ácido sulfúrico y agua (reacción de hidratación) es una reacción exotérmica que produce una gran cantidad de calor, si una cantidad pequeña de agua es adicionada a un recipiente con ácido sulfúrico concentrado esta puede producir salpicaduras explosivas muy peligrosas. Una explicación para esto puede deberse a la densidad de los dos líquidos, siendo el ácido más denso el agua tenderá a flotar sobre este.
Debido a esta afinidad del ácido por el agua este puede remover los átomos de hidrogeno y oxigeno de otros compuestos, por lo que produce la deshidratación de compuestos orgánicos como papel, madera, tejidos o azúcar, dejando solo un residuo carbonoso. Con la siguiente imagen podrán observar este efecto, al dejar caer unas gotas de ácido sulfúrico concentrado sobre una servilleta de papel esta se quema al instante, dejando un borde carbonizado entorno al sitio donde caen las gotas.

Quemaduras de ácido sulfúrico en una servilleta de papel. Fuente: @emiliomoron.
Peligros y seguridad
En el laboratorio
El ácido sulfúrico tiene propiedades extremadamente corrosivas, que se ven acentuadas por su violenta liberación de calor en las reacciones de deshidratación. Las quemaduras que puede producir el ácido sulfúrico son potencialmente más graves que las que pueden producir cualquiera de los otros ácidos fuertes. Y el peligro aumenta mientras mayor sea la concentración, por ello, una norma general de cualquier laboratorio para realizar la preparación de una solución diluida de ácido sulfúrico es agregar progresivamente el ácido sobre el agua y con agitación y nunca lo contrario, verter el agua sobre el ácido.
En la industria
El ácido sulfúrico es un químico muy peligroso, es extremadamente corrosivo. Las bajas concentraciones del ácido sulfúrico no se consideran peligrosas, sin embargo una exposición prolongada aumenta el riesgo de sufrir quemaduras en el tracto respiratorio por su inhalación o en la piel por contacto. Y dado que solo las soluciones concentradas son altamente corrosivas, puede que se sobreestime la peligrosidad de las soluciones a baja concentración. Su ingestión es poco frecuente, pero es fatal, causa graves daños al sistema gastrointestinal. Por lo que su manipulación en la industria de los fertilizantes, así como otras que utilizan este ácido en sus procesos, requiere de atender a la protección adecuada, como mascarilla y guantes de nitrilo.
Referencias
1. Enciclopedia Britanica. Sulfuric acid.
2. Ficha de datos de seguridad del ácido sulfúrico Merck.
3. New World Encyclopedia. Sulfuric acid.
4. Carrillo, J. y col. (2012). Elaboración de un detergente líquido. Universidad de los Andes-Venezuela.
5. A.S.H Ong (1990). Oleoquímicos derivados del aceite de palma y palmiste. Revista Palmas, vol. 11, Nº2.
6. Speight, James G. (2017). Environmental Inorganic Chemistry for Engineers. Elsevier Inc.

Si desean consultar otros artículos de calidad en áreas de Ciencia, Tecnología, Ingeniería y Matemáticas (STEM, por sus siglas en inglés) en nuestro idioma español pueden hacerlo visitando la etiqueta #stem-espanol, también puedes realizar tus aportes, para ello revisa los criterios de curación y además la normativa para el uso de imágenes en la siguiente publicación: https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol.

