Cuando en química hablamos de resonancia estamos haciendo referencia a otra forma de dibujar la estructura de una molécula. Así, las estructuras de Lewis que resultan equivalentes se denominan formas de resonancia; específicamente se utilizan cuando existe más de una forma de representar enlaces dobles y pares solitarios en la estructura de puntos de Lewis que satisfagan la regla del octeto. Recordemos que esta regla es la que establece que los átomos ganan, pierden o comparten electrones con la finalidad de completar ocho electrones en su última capa electrónica.
A diferencia de los isómeros, los cuales tienen una disposición diferente de átomos y electrones; mientras que las estructuras de resonancia solo difieren en la disposición de los electrones. Veamos por ejemplo la estructura del benceno.

Formas de resoancia del benceno y estructura general.
Este compuesto orgánico presenta resonancia; si nos fijamos en la figura anterior, presenta dos posibles formas de ubicar los enlaces dobles entre átomos de carbono. Otro ejemplo lo podemos encontrar en la molécula de ozono.

Resonancia del ozono. Tomado de wikipedia.com
Como podemos apreciar, en esta molécula se puede ubicar de dos formas el doble enlace entre átomos de oxigeno.
Teoría de resonancia
Algunos postulados de la teoría de resonancia que podemos aplicar en el benceno, así como en otros compuestos aromáticos son:
- Las estructuras de resonancia no son reales. Por ejemplo, la estructura del benceno única, en la que se combinan ambas formas de resonancia.
- En las estructuras resonantes ni la posición, ni la hibridación de los átomos cambia de una estructura a otra. En el benceno los seis núcleos de carbono forman un hexágono regular, mientras que los electrones Pi son compartidos por igual entre los núcleos vecinos, y todos los enlaces son equivalentes.
- Las estructuras de resonancia no son necesariamente equivalentes. Pero mientras más equivalentes resulten más estable será la molécula.
- Y por otro lado, tanto más estructuras de resonancia existan, igualmente más estable será la molécula.
Estabilidad del benceno
El benceno, con sus dos formas de resonancia es bastante estable. Y por ello, en cuanto a reacciones químicas se refiere, el benceno no se comporta como un alqueno. Por ejemplo no reacciona con permanganato de potasio para formar productos de ruptura, ni con ácido acuoso para generar alcoholes, ni tampoco con HCl gaseoso para producir halogenuros de alquilo.
Si comparamos los calores de hidrogenación, en el ciclo hexeno se observa una variación de 28 Kcal/mol; y el 1,3-ciclo hexadieno presenta una variación de 55 Kcal/mol, es decir, casi el doble que el primero. De esto se podría esperar entonces que para el ciclo hexatrieno (es decir, el benceno) el calor de hidrogenación fuese de tres veces el valor del ciclo hexeno, sin emabrgo es de 49 kcal/mol.
Dibujo de formas de resonancia
Hay varias cosas que debemos tener en cuenta antes y después de dibujar las formas de resonancia. Primero debemos saber dónde están los electrones no enlazantes, realizar un seguimiento de las cargas formales en los átomos y no romper los enlaces sigma. Finalmente, después de dibujar la forma de resonancia, asegurarnos de que todos los átomos cumplen con la regla del octeto. Marcarlos hará que dibujar formas de resonancia sea más fácil.
Al dibujar una estructura de resonancia debemos recordar:
Solo los electrones se mueven y los núcleos de los átomos nunca se mueven.
Los electrones que pueden moverse son los electrones pi, los electrones individuales no apareados y los electrones de par solitario.
El número total de electrones en la molécula no cambia y tampoco lo hace el número de electrones emparejados y no emparejados.
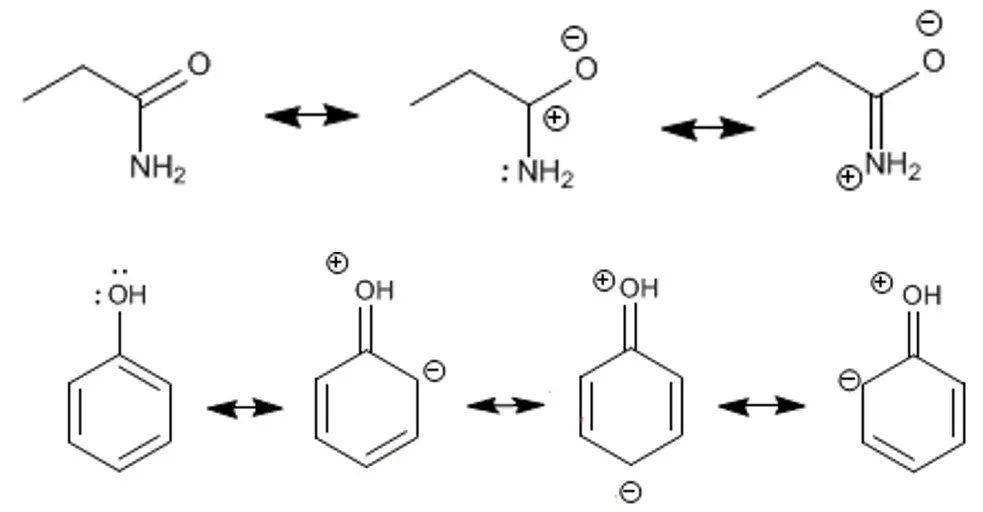
Otros ejemplos. Arriba la propanamida, abajo el fenol.
Y comprobemos siempre la carga neta después de cada estructura. Bueno amigos, con estos detalles importantes pueden asegurar el éxito al dibujar cualquier estructura de resonancia.

Referencias:
Chemistry libre texts. Resonance forms.
Morrison, R. T. y Boyd, R. N. (1990). Química Orgánica Quinta Edición.
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2020/03/resonancia-y-las-formas-del-benceno
